Dossier | Le secteur de la santé post-Covid : un changement de paradigme ?
Les médicaments sont-ils trop chers en France ?
Quel est le juste prix à payer pour des médicaments ? De la fixation des prix à la régulation des dépenses.
Article de Pierre Lévy, maître de conférences à l'Université Paris Dauphine - PSL
Récemment, plusieurs organisations (Médecins du monde, la Ligue contre le cancer, …) se sont élevées contre le prix de médicaments jugés trop onéreux 1. Dans les toutes dernières années à l’inverse, le manque de nouveaux antibiotiques et la pénurie croissante de médicaments ont conduit à s’interroger sur l’influence négative de prix trop bas. La question du juste prix du médicament est ainsi posée de façon récurrente en France comme dans la plupart des pays compte tenu de la dynamique des dépenses 2.
Pour éclairer cette question, nous nous intéresserons d’abord à la fixation des prix en France en explicitant le processus d’évaluation et de décision sous-jacent. Il faudra ensuite le resituer dans le contexte plus large de la régulation des dépenses de médicaments remboursés par l’assurance maladie qui joue sur les prix de façon dynamique mais aussi sur d’autres leviers. C’est dire que la fixation du prix initial au lancement d’un médicament n’est qu’une composante de la régulation globale des dépenses.
« Entre 2010 et 2020, le prix des médicaments en ville a baissé en moyenne de 4,2% par an »
Un constat chiffré illustre cette importance de la régulation et de son impact sur les prix. Entre 2010 et 2020, le prix des médicaments en ville a baissé en moyenne de 4,2% par an, cette forte pression sur les prix permettant une baisse globale de la consommation de médicaments ambulatoires de 1,2 % en moyenne annuelle entre 2014 et 2020 du fait d’une augmentation des volumes de prescription 3. On note une certaine inflexion depuis qui pourrait être révélatrice d’une évolution de la régulation, avec une baisse des prix qui n’est plus que de 3,3% en 2021 et de 3,4% en 2022, accompagnant une augmentation de la dépense ces années-là, de 4,3% puis 5,3%.
Les médicaments, des produits particuliers
Du fait de leurs caractéristiques distinctives rendant les mécanismes de marché défaillants, la détermination du prix des médicaments se fait selon des modalités particulières :
- Pour inciter les entreprises à investir en R&D, la mise au point d’un nouveau médicament est protégée par un brevet garantissant une période d’exclusivité. La situation de monopole temporaire qui en résulte permet d’espérer des profits attractifs mais elle appelle un certain contrôle sur les prix (ou les profits) pour éviter les abus de position dominante ;
- Les dépenses de santé étant largement socialisées à travers l’assurance santé, le patient-consommateur de soins ne paie pas directement les médicaments qu’il consomme. En 2022, sur une dépense de médicaments de ville remboursables de 26,5 millions €, l’assurance maladie obligatoire en a remboursé 87%, les médicaments délivrés à l’hôpital étant pris en charge à 100% (source Medic’AM 2022). Même s’ils peuvent avoir à supporter un reste à charge, les patients ne sont pas très sensibles aux prix, d’autant plus que la prescription est déterminé par le médecin.
Pour ces raisons, le processus de régulation économique utilise des modalités de fixation des prix tout au long du cycle de vie des médicaments sur la base d’une évaluation principalement clinique et plus marginalement économique.
Le processus d’évaluation et de décision en France
On distingue deux phases dans le processus décisionnel permettant l’accès au marché :
- La première phase, dite réglementaire, concerne l’autorisation de mise sur le marché (l’AMM), obligatoire avant toute commercialisation. Elle est donnée généralement par la commission européenne après avis favorable de l’European Medicine Agency (EMA), cette procédure centralisée s’appliquant à l’ensemble des pays de l’union européenne. La décision est prise en fonction de la balance bénéfice/risque sur la base d’études contrôlées visant à démontrer l’efficacité, la sécurité d’emploi et la qualité pharmaceutique des médicaments ;
- La seconde phase, dite de Health Technology Assessment (HTA), porte sur la décision de remboursement et de prix. Compte tenu de la spécificité des systèmes de santé nationaux, chaque pays européen définit son propre processus d’évaluation et de décision. Il existe en général au moins une agence par pays en charge de supporter cette phase HTA, à l’instar de la Haute Autorité de Santé (HAS) en France. Une des évolutions en cours concerne le transfert de la partie scientifique de l’évaluation au niveau européen devant avoir lieu progressivement à partir de 2025, ce qui fait débat par son impact potentiel sur la souveraineté nationale en termes de décision 4.
Les critères cliniques utilisés pour les décisions de remboursement et de prix
Pour les questions relatives au remboursement et au prix, on considère en France deux critères principaux, de nature clinique, le Service Médical Rendu (SMR) et l’Amélioration du Service Médical Rendu (ASMR).
C’est la Commission de la Transparence (CT) constituée au sein de la HAS qui est chargée d’évaluer, dans un avis rendu public, le SMR et l’ASMR de chaque nouveau médicament sur la base d’une doctrine régulièrement actualisée 5. Cette double évaluation clinique alimente le schéma décisionnel de l’HTA en France, la question du remboursement étant traitée avant de considérer éventuellement celle du prix (voir graphique n°1).
Graphique n°1 :Le processus d’évaluation et de décision en France
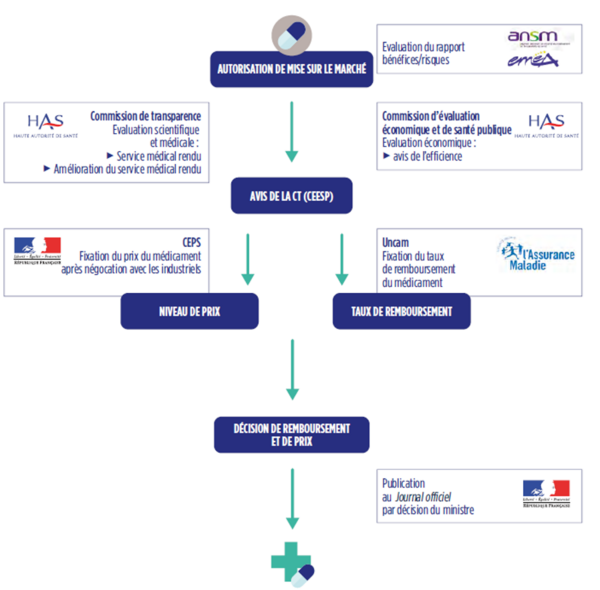
Source : Bilan économique, édition 2022. Les entreprises du médicament en France. Leem.org
Dans un premier temps, on détermine, à la demande de l’industriel, si un médicament peut être remboursé par l’assurance maladie obligatoire et, le cas échéant à quel taux. On se réfère pour cela au SMR qui répond à la question : le médicament a-t-il suffisamment d’intérêt pour être pris en charge par la solidarité nationale ?
« On distingue 4 niveaux de SMR (important, modéré, faible, insuffisant) qui conditionnent le remboursement et son niveau »
Le SMR est déterminé notamment par l’efficacité et les effets indésirables du médicament, sa place dans la stratégie thérapeutique et la gravité de l’affection. On distingue 4 niveaux de SMR (important, modéré, faible, insuffisant) qui conditionnent le remboursement et son niveau. Si le SMR est jugé insuffisant, le médicament n’est pas remboursé. Dans les autres cas, il est remboursé à un taux qui varie de 65 % si le SMR est jugé important (voire 100% pour les médicaments jugés irremplaçables et particulièrement coûteux), à 30% (SMR modéré) ou 15% (SMR faible).
La CT définit aussi le niveau d’ASMR qui répond à la question : le médicament apporte-t-il un progrès par rapport aux traitements disponibles, et le cas échéant, à quelle hauteur ? Il prend en compte l’efficacité et de tolérance comparatives par rapport aux alternatives thérapeutiques existantes. Il existe 5 niveaux d’ASMR, de I (majeur) à V (absence de progrès).
Dans un second temps, on détermine le prix de vente pour les médicaments de ville ou le tarif de responsabilité (TR) pour certains médicaments délivrés à l’hôpital. Cette décision est du ressort du Comité Economique des Produits de Santé (le CEPS) qui est un Comité interministériel et interinstitutionnel. Considéré comme mesurant la valeur thérapeutique relative du médicament, l’ASMR constitue le principal déterminant du prix négocié avec le CEPS selon des modalités qu’il faut préciser 6.
La détermination du prix lors de la mise sur le marché des médicaments
Dans tous les cas, l’avis de la CT est pris en compte par le CEPS qui va surtout considérer la valeur clinique du médicament tel qu’exprimée par l’ASMR. Depuis octobre 2013, il a été décidé que, pour les médicaments se réclamant les plus innovants, des informations sur leur valeur économique devaient également être fournies sous la forme d’une étude de type coût-efficacité, éventuellement complété d’une analyse d’impact budgétaire.
Ces études, visant à déterminer le degré d’efficience et l’abordabilité financière du médicament, sont expertisées par une commission spécifique de la HAS, la Commission d’Evaluation Economique et de Santé Publique (CEESP). Le CEPS dispose ainsi d’informations relatives à la valeur économique du produit en complément de la valeur clinique fournie par l’ASMR.
L’ASMR donnée par la CT joue bien un rôle majeur dans le processus de tarification en conditionnant notamment la possibilité ou non de bénéficier de la garantie de prix européen :
- Les médicaments qui obtiennent une ASMR de niveau I à III, ainsi jugés innovants (mais aussi ceux qui obtiennent une ASMR IV sous certaines conditions ), donnent lieu à la détermination de deux prix. D’un côté, le prix facial ou prix liste relève de cette garantie de prix européen selon laquelle ce prix est défini par les prix du même produit dans les 4 autres grands marchés européens (l’Allemagne, l’Espagne, l’Italie et le Royaume Uni), le CEPS s’engageant à garantir que le prix en France ne sera pas inférieur au prix pratiqué le plus bas sur ces 4 autres marchés. Ce sont ces prix liste souvent très élevés qui conduisent à des réactions indignées. Mais ceci peut être trompeur car, d’un autre côté, le prix net qui sera vraiment payé par l’assurance maladie, et qui n’est pas rendu public, est négocié en fonction du prix des médicaments comparables en France, donnant lieu à une remise que l’industriel devra rembourser en fin d’année (près de 2,9 milliards € en 2021). Ce découplage entre un prix liste et un prix net doit être compris comme une faveur accordée aux médicaments innovants, leur permettant de négocier des prix plus élevés sur des marchés étrangers ;
- Pour un médicament obtenant une ASMR IV, le principe général est celui d’une parité de prix avec son comparateur, l’entreprise devant pouvoir augmenter ses parts de marché et trouver là une rémunération suffisante pour une innovation mineure, tout en étant financièrement neutre pour l’assurance maladie ;
- Pour les produits ayant une ASMR V, le code de la sécurité sociale stipule qu’ils doivent apporter une « économie dans le coût de traitement médicamenteux » pour être pris en charge par l’assurance maladie. Le principe est donc ici, sauf exception, celui d’une baisse de prix.
Pour les génériques et les biosimilaires, des règles spécifiques ont été élaborées. Pour les génériques distribués en ville, des baisses de prix sont prévues pour le princeps et les génériques (voir graphique n°2). S’agissant des produits biologiques, la règle désormais établie prévoit une baisse de prix du biomédicament de référence à la chute du brevet de 20% et une décote de 40% pour les biosimilaires.
Graphique n°2. La dynamique d’ajustement du prix des génériques
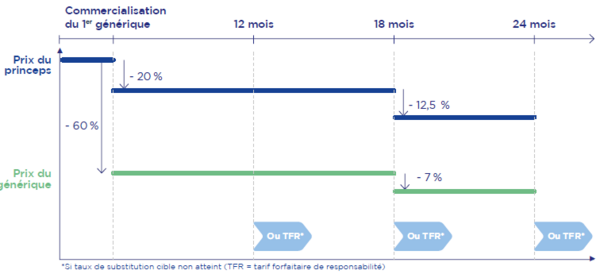
Source : Bilan économique, édition 2022. Les entreprises du médicament en France. Leem.org
« La faible rémunération d’un nombre croissant de médicaments est identifiée comme l’une des causes de l’augmentation du nombre de pénuries »
Au cours des 10 dernières années, plus de la moitié des nouveaux médicaments ont eu un ASMR V 7, conduisant à des prix jugés faibles. Joint à la part croissante des génériques et des vieux médicaments à bas prix dans les prescriptions, la faible rémunération d’un nombre croissant de médicaments est identifiée comme l’une des causes de l’augmentation du nombre de pénuries 8. Un rapport du Sénat pointe également le déclin de la production française, conséquence de 40 ans de délocalisation et une stratégie commerciale et financière portée vers les médicaments innovants et onéreux au détriment des médicaments matures.
Pour lutter contre ce que certains estiment être une perte de souveraineté, différentes initiatives ont été prises ou sont en cours de développement. Le CEPS a ainsi été amené récemment à accepter quelques modestes hausses de prix sur certains médicaments en tension de façon à améliorer un approvisionnement qui privilégie les marchés étrangers plus rémunérateurs. Par ailleurs, les modalités de mise en œuvre d’une prime de prix pour des investissements industriels sur le territoire national sont en cours d’élaboration, de façon à restaurer l’importance de l’industrie pharmaceutique française 9.
Il n’en reste pas moins que, même si les comparaisons internationales sont délicates à faire, le prix des médicaments en France sont connus pour être plus bas que dans la quasi-totalité des pays européens, comme on peut le voir sur le graphique n°3 issu d’une étude suédoise 10.
Graphique N°3. Comparaison du prix des médicaments en Europe aux prix français pour les médicaments sous brevet (à gauche) et ayant perdu leur brevet (à droite)
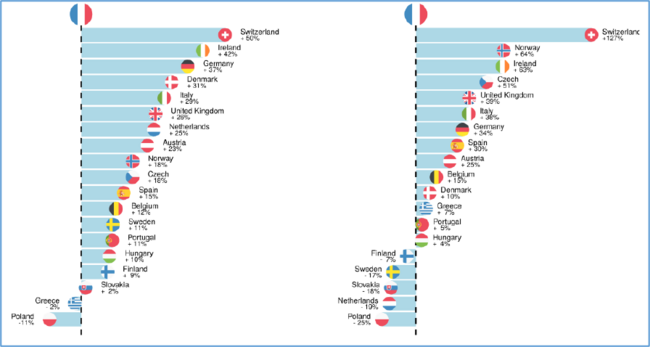
Source : The Dental and Pharmaceutical Benefits Agency. International Price Comparison 2020 An Analysis of Swedish Pharmaceutical Prices in Relation to 19 European Countries.
Régulation de la dépense et fixation des prix
Si la fixation du prix des médicaments remboursés est l’élément central de la régulation économique des dépenses, d’autres instruments de contrôle sont à la disposition du CEPS. Comme on peut le voir sur le tableau ci-dessous, la régulation du CEPS par les baisses de prix et les remises portent sur des montants très importants. A elles seules, les remises ont décuplé depuis 2012 pour représenter en 2021 près de 4,9 milliards €, soit 12,5% du CAHT.
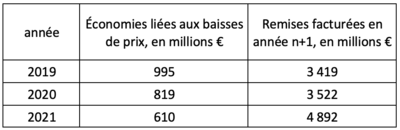
À l’échelle microéconomique, outre la fixation du prix, certains outils comme les clauses négociées de remise qui ne sont pas rendues publiques ont pour effet de réduire la dépense effective par rapport au prix public. Ce peut être des clauses de volume pour encadrer le volume des ventes et inciter le laboratoire à faire respecter la prescription à la population cible, ou des clauses de CTJ pour contrôler les posologies, des clauses de remise à la 1re boîte, etc. 6.
« Différents mécanismes de révision de prix ou de « contributions » sont mis en œuvre pour réguler la dépense »
Plus globalement, différents mécanismes de révision de prix ou de « contributions » sont mis en œuvre pour réguler la dépense, que ce soit pour une classe thérapeutique, une indication, voire l’ensemble des médicaments. À partir du cadrage macroéconomique que constitue l’ONDAM, en particulier l’objectif sur le taux de croissance annuel de la dépense de médicaments remboursés voté dans le cadre de la LFSS, le CEPS met en œuvre une régulation a priori sous la forme de baisses de prix ou tarifs. Et, si nécessaire, une régulation a posteriori, dite « clause de sauvegarde » par des contributions ou remises de régulation pour respecter le taux de croissance prévu.
Par ailleurs, ces instruments de régulation sont mis en œuvre non seulement au moment de la mise sur le marché des médicaments mais durant tout leur cycle de vie, de façon à tenir compte de l’évolution de l’arsenal thérapeutique et de l’information additionnelle qui peut être obtenue en vie réelle sur leur efficacité, leur tolérance et leurs modalités de prescription. Ceci conduit à une révision des prix initiaux selon différentes modalités. Moins fréquemment, si un contrat de performance a été établi compte tenu de l’incertitude sur les effets du médicament lors de son lancement, une baisse de prix ou des remises peuvent avoir été prévues en cas de résultats en vie réelle moins favorables que lors des essais cliniques.
Remarques finales
Deux points peuvent être soulignés. D’une part, l’environnement européen joue sur le dispositif français, à la fois par la prise en compte des prix européens pour les médicaments les plus innovants, par la révision du processus décisionnel intégrant une dimension économique en plus de la dimension clinique, et par la future évaluation commune européenne.
D’autre part, la régulation « à la française » a montré ses limites, compte tenu de la délocalisation de la production et des pénuries croissantes de médicaments liées à la pression sur les prix qui ne suffit plus à libérer un budget suffisant pour financer les innovations thérapeutiques. Si elle a déjà fait l’objet d’adaptations, d’autres ajustements s’avèrent nécessaires comme en atteste la mission confiée par la première ministre à un groupe d’experts en janvier 2023 11.
Ce contenu est publié sous licence Creative Commons
Notes & Références
- Le Galès C. Pourquoi les nouveaux médicaments sont-ils si chers ? Med Sci (Paris). 2018.
- IQVIA. Drug Expenditure Dynamics 1995–2020. Understanding Medicine Spending in Context. IQVIA Institute for Human Data Science; 2021.
- Arnaud F, Lefebvre G. Les Dépenses de Santé En 2022. Résultats Des Comptes de La Santé. Edition 2023. DREES, Ministère de la santé; 2023.
- Drummond M, Tarricone R, Torbica A. European union regulation of health technology assessment: what is required for it to succeed ? Eur J Health Econ. 2022;23.
- Commission de la Transparence. Doctrine de La Commission de La Transparence (CT). Principes d’évaluation de La CT Relatifs Aux Médicaments En Vue de Leur Accès Au Remboursement. Haute Autorité de Santé; 2023.
- Comité Economique des Produits de Santé. Rapport d’activité 2021. Comité Economique des Produits de Santé; 2022.
- Commission de la Transparence. Rapport d’activité 2022. Haute Autorité de Santé; 2023.
- Sénat. Rapport Fait Au Nom de La Commission d’enquête Sur La Pénurie de Médicaments et Les Choix de l’industrie Pharmaceutique Française. Sénat; 2023
- Marquay J, Cave P, Leridon N, Vinson L, Pichard A. Poids de La Régulation de l’industrie de Santé et Contribution Du G5 Santé à l’économie En 2022. BDO Advisory - BIPE; 2023.
- The Dental and Pharmaceutical Benefits Agency. International Price Comparison 2020 An Analysis of Swedish Pharmaceutical Prices in Relation to 19 Other European Countries.; 2020.
- Audier A, Biot claire, Collet F, Epis de Fleurian AA, Léo M, Lignot-Leloup M. Pour Un “New Deal” Garantissant Un Accès Égal et Durable Des Patients à Tous Les Produits de Santé - La Durabilité Intégrant Les Notions de Soutenabilité Financière, de Résilience et d’impact Environnemental. Mission de régulation des produits de santé; 2023.
Liste des abréviations
- AMM : Autorisation de Mise sur le Marché
- ANSM : Agence Nationale de Sécurité des Médicaments
- ASMR : Amélioration du Service Médical Rendu
- CAHT : Chiffre d’Affaires Hors Taxes
- CEESP : Commission d’Evaluation Economique et de Santé Publique
- CEPS : Comité Economique des Produits de Santé
- CT : Commission de la Transparence
- EMA : European Medicines Agency
- HTA : Health Technology Assessment
- JO : Journal Officiel
- LEEM : Les Entreprises du Médicament
- LFSS : Loi de Financement de la Sécurité Sociale
- ONDAM : Objectif National de Dépenses d’Assurance Maladie
- PUI : Pharmacie à Usage Intérieur
- R&D : Recherche et Développement
- SMR : Service Médical Rendu
- T2A : Tarification A l’Activité
- UNCAM : Union nationale des Caisses d’Assurance Maladie
À lire aussi
Les réseaux sociaux ont profondément transformé la finance. Ils donnent un pouvoir inédit aux récits, aux émotions et à l’influence. Un post peut...
En permettant de « consommer » son patrimoine sans renoncer à son toit, le viager pourrait être un outil majeur de rééquilibrage social et...
FRANCE CULTURE | La taxe Zucman, qui propose de taxer de 2 % les foyers ayant un patrimoine supérieur à 100 millions d'euros, continue de faire débat....




